オゾンの概要
オゾンとは?
オゾン
| 語源 | ギリシャ語(OZEIN/臭う) |
| 分子式 | O3 |
| 分子量 | 48(空気より重く、通常は気体(沸点-112℃)) |
| 不安定、速やかに反応。反応後は酸素に。 | |
| 酸化力が強い。(自然界でフッ素についで2番目) |
酸化力比較表
| 酸化剤 | 酸化還元電位(V) |
|---|---|
| フッ素 | 2.87 |
| オゾン | 2.07 |
| 塩素 | 1.78 |

オゾン取扱いの注意
許容値
- 0.1ppm 日本産業衛生学会(1985年)
- 0.1ppm ACGIH(1961年)
1日8時間、週40時間程度の労働時間中に、肉体的に激しくない労働に従事する場合の暴露程度の算術平均(可逆的な若干の変化は身体機能の低下をもたらさなければ許容する立場)。
ただし、0.1ppm以下の濃度であっても注意が必要です。
オゾンの作用
| オゾン(ppm) | 作用 |
|---|---|
| 0.01~0.02 | 多少の臭気を覚える。(やがて馴れる) |
| 0.1 | 明らかな臭気があり、鼻やのどの刺激を感じる。 |
| 0.2~0.5 | 3~6時間暴露で視覚を低下する。 |
| 0.5 | 明らかに上部気道に刺激を感じる。 |
| 1~2 | 2時間暴露で頭痛、胸部痛、上部気道の渇きとせきが起こり、暴露を繰り返せば慢性中毒にかかる。 |
| 5~10 | 脈拍増加、体痛、麻酔症状が現れ、暴露が続けば肺水腫を招く。 |
| 15~20 | 小動物は2時間以内に死亡する。 |
| 50 | 人間は1時間で生命危険となる。 |
オゾンは酸素原子3個からなる強力な酸化剤であり、その酸化力により細菌やウイルスを除菌・不活化する能力を有しております。
これは以前より周知されておりましたが、従来法である塩素系薬剤、ホルマリン、エチレンオキサイド等の残留性や副生成物による環境負荷問題から、近年とくに注目をされております。
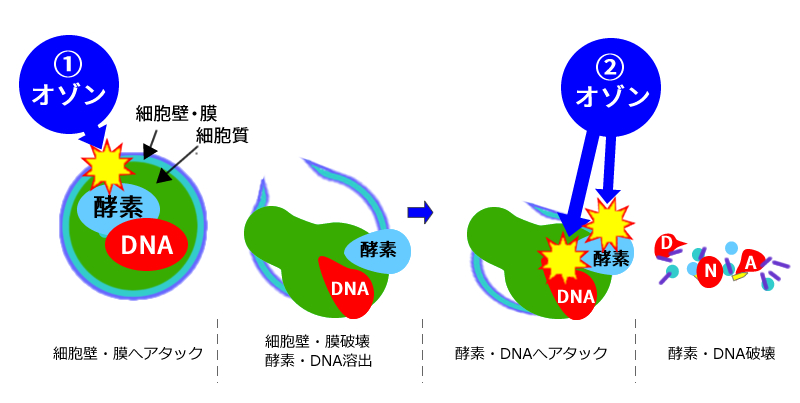
オゾンの除菌メカニズム(細菌)
| ① |
|
||||
| ② |
|
||||
| いわゆる①と②マルチポイント攻撃である⇒耐性菌ができない | |||||
各除菌方法の特徴
| 種類 | 特長 | 留意点 | |
|---|---|---|---|
| ガス | オゾンガス | 酸素に戻る環境にやさしい物質 除菌効果が高い 副生成物が生成しない |
有毒 独特な臭気 残留ガス処理必要(高濃度のみ) 金属腐食・樹脂侵食(高濃度のみ) |
| エチレンオキサイドガス (EOG滅菌) |
ガスが残留する 医療器材への使用が多い 金属腐食・樹脂侵食がない |
有毒、発がん物質 エーテル臭 残留ガス処理が必須 |
|
| ホルマリンガス | ガスが残留する エチレンオキサイドより使用濃度は低い 金属腐食・樹脂侵食がない |
有毒、発がん物質、刺激臭 残留ガス処理が必須 |
|
| 液体 | オゾン水 | 酸素に戻る環境にやさしい物質 除菌効果が高い 副生成物が生成しない |
残留性がない 金属腐食・樹脂侵食(高濃度のみ) 揮発し、オゾン臭 |
| 次亜塩素酸 | 除菌剤として様々な分野で使用 残留性が高い |
有機塩素化合物(トリハロメタン等)の副生成物の生成 | |
| アルコール類 | 高濃度で除菌効果が高い 揮発性あり |
揮発性あり 手荒れ アルコール臭 引火性あり |
|
| 他 | 紫外線 | 生活環境や様々な分野実績あり ランプ照射で、残留物なし |
除菌した菌の回復に注意 |
除菌方法の比較(ガス)
| オゾンガス | エチレンオキサイドガス | ホルマリンガス | |
|---|---|---|---|
| 除菌メカニズム | 細菌・ウイルスのDNA/RNA、蛋白と反応、酸化分解することで、除菌 | ||
| 使用濃度 | 低 | 高 | 中 |
| 発がん性 | 無し | 有り | 有り |
| 対象物への残留性 | ほとんどなし (自己分解する) |
残留注意 (分解し難い) |
残留注意 (分解し難い) |
| 取扱易さ | 易 | 難 | 難 |
除菌方法の比較(液体)
| オゾン水 | 次亜塩素酸水 | アルコール | |
|---|---|---|---|
| 除菌メカニズム | 細胞壁・膜の構造破壊 酵素・DNA破壊 耐性菌できない |
- 酵素損傷(阻害) 耐性菌できる |
酵素損傷(阻害) 細胞壁・膜脂質破壊 耐性菌できる |
| 使用濃度 | 0.5~数mg/L | 50mg/L以上 | 50〜90%程度 |
| 環境等への影響 | ほとんどなし (自己分解する) |
有毒な塩素ガスや 副生物生成 |
手荒れ、食品変性、 |
| 取扱易さ | 易 | 難 | 易 |
| 除菌力 | 大 | 小 | 中 |
除菌方法の比較(その他)
| オゾンガス | 紫外線 | |
|---|---|---|
| 除菌メカニズム | 酵素・DNAを破壊 | DNA構造を変化 |
| 発がん性 | 無し | 有り(皮膚がん) |
| 除菌特性 | 耐性菌できない | 除菌した菌の回復に注意 |
| 除菌範囲 | 対象物の内部まで除菌 | 対象物の表面のみ除菌 |
| 環境等への影響 | ほとんどなし (自己分解する) | なし |
| 取扱易さ | 易 | 易 |
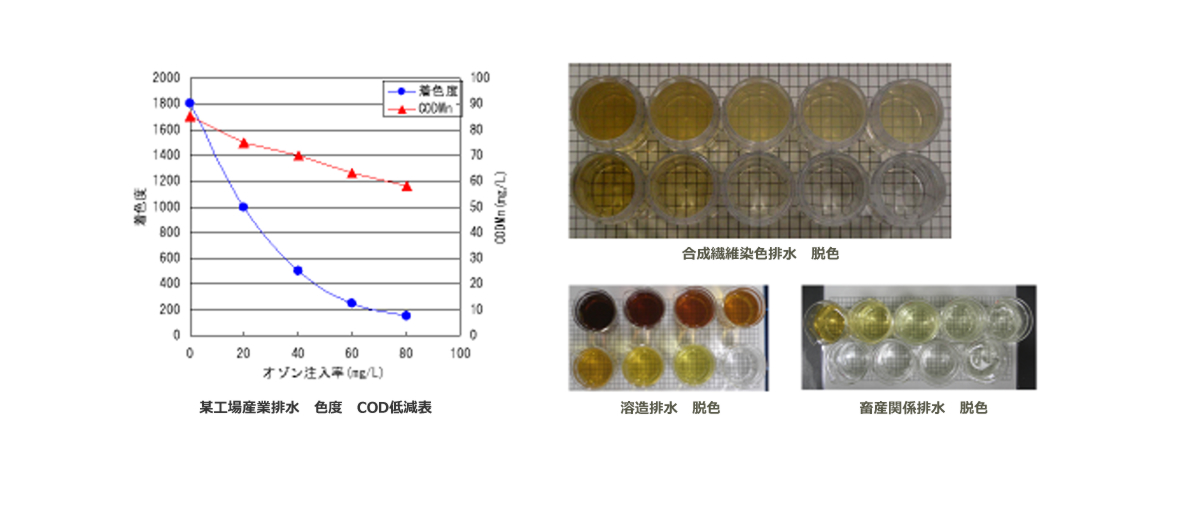
またオゾンは強力な酸化力により脱色効果も有しております。
脱色効果
生活汚水や産業排水の着色原因となる分子有する不飽和二重結合を、酸化分解し化学構造を変更させることにより脱色効果が得られます。